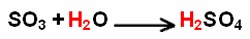|
Bilan de la réaction chimique
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'équation bilan
Une réaction chimique
correspond à la transformation de réactifs en produits.
coefficients
st*chiométriques L'équation bilan (ou équation
st*chiométrique) établit les rapports qualitatifs et quantitatifs associés à la
transformation considérée. Les réactifs sont consommés
(détruits), les produits sont créés. La proportion avec laquelle ils réagissent est
spécifiée par les coefficients
st*chiométriques.
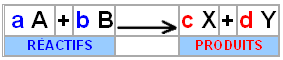
On note une réaction
chimique avec :
La flèche indique le sens
du déroulement de la réaction. Une double flèche indique que la réaction donne
lieu à un équilibre chimique.
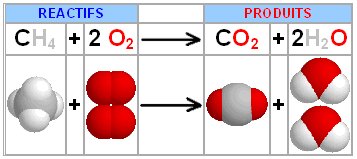
L'équation chimique d'une
réaction correspond à une transformation microscopique impliquant des atomes et
des molécules. L'hypothèse d'Avogadro transpose l'équation chimique à
l'échelle macroscopique (atome - grammes - moles).
On constate donc que l'équation chimique
est un outil très utile et simple pour décrire quantitativement une réaction
chimique.
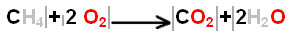
Le bilan de l'equation chimique
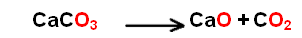
conservation des éléments chimiques Le bilan de masse
traduit
le principe de la conservation de la masse par la conservation des éléments chimiques au cours d'une réaction.
Si la réaction fait
intervenir des ions la réaction devra également
respecter la conservation des charges électriques,
c'est à dire que l'on devra avoir les mêmes sommes de charges
à droite et à gauche de la flèche.
En conséquence,
lorsque des gaz interviennent, les volumes ne se conservent pas toujours (le
mélange se faisant avec contraction ou augmentation du volume) puisque la
composition molaire est égale à la compositions volumique.
Les électrons ne
peuvent pas non plus être crées ou détruits. Les charges électriques se
conservent globalement: les charges totales (somme algébrique des charges)
doivent être égales (équilibre du bilan
électrique).
|
||||||||||||||||||||||||||||||||||||||||||||||||||