|
Configuration électronique des éléments
|
|
||||||||||||||||||||||||||||||||||
|
Configuration électronique des éléments
Chaque atome possède une structure ou configuration électronique
complète (ou réduite) qui rend compte des niveaux d'énergie occupés par
ses électrons. La configuration électronique
d'un atome est la façon dont les électrons (du nombre Z=A-N) sont distribués
entre les couches, sous-couches et cases quantiques.
On utilise une notation standard pour
décrire la configuration des électrons de l'atome. Selon cette notation, une
sous-couche est notée sous la forme
Les sous-couches de l'atome sont décrites
dans l'ordre croissant d'énergie - en d'autres termes, la séquence selon
laquelle elles sont remplies
L'état fondamental
Il est facile d'établir à priori la configuration
électronique de l'élement dans son état fondamental (énergie de l'atome
minimale).
Il existe un certain nombre d'exceptions pour des éléments
au-delà de Z=18,.dont le niveau d est incomplètement remplies. Le tableau
pressenté reprend la configuration électronique des premiers 86 éléments du
tableau périodique dans leur état fondamental, en soulignant les exceptions à
la règle de Kletchkowski (notées par *). Par
exemple, le chrome Cr (Z= 24) a une configuration de [Ar] 3d54s1,
et non [Ar] 3d44s2. De la même manière,. le cuivre Cu (Z=
29) a une configuration de [Ar] 3d104s1, et non [Ar] 3d94s2 comme on pourrait le supposer selon le principe de l'énergie
minimale.
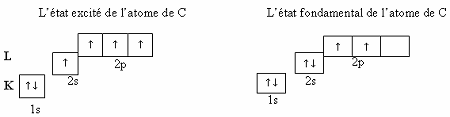
Les états excités
L'état fondamental d'un système est l'état de plus basse énergie. Si, à la suite d'un apport extérieur, l'énergie de l'atome augmente,
on dit que l'atome se trouve dans un état excité. Cet état est instable,
c'est-à-dire que sa durée d'existence est très brève : l'atome excité revient
dans l'état stable d'énergie la plus basse.
La couche de valence
Les électrons de la
couche de nombre n le plus élevé dans l'état fondamental constituent la couche externe, ou couche de
valence, ou encore couche périphérique.
L'existance dans
cette couche de doublets, d'électrons célibataires et des cases vides déterminent dans une
mesure importante les propriétés chimiques. Par exemple la couche K qui est la
plus proche du noyau est toujours saturée avec 2 électrons. La couche le plus à
l'extérieur de la plupart des atomes n'est pas complète, elle peut ainsi
accepter (provisoirement) des électrons, ou éventuellement en perdre. C'est le
cas lors de l'ionisation d'un atome. Les gaz rares (hélium, néon, krypton...)
ont la couche la plus extérieure qui est toujours saturée, ils sont inertes sur
le plan chimique.
Dans les formes
réduites pour la description de la configuration électronique souvent l'on représente les
premières couches remplies par leur symbole, et l'on donne une description
détaillée du placement des électrons de valence dans la couche externe.
|
||||||||||||||||||||||||||||||||||