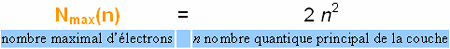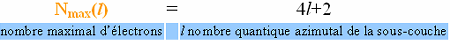|
Règles de remplissage des orbitales
|
|
||||||||||||||||
|
Principe
d'exclusion de Pauli
"Dans un atome, il ne peut y avoir plus d'un électron décrit par
un même ensemble de valeurs données aux quatre
nombres quantiques"
A chaque triplet n, l et m est associée une case quantique. Puisque les électrons n'ont que deux valeurs possibles de spin (nombre quantique s = +1/2 /-1/),
une case ne peut
comporter plus de 2 électrons.
Donc, chaque
case quantique peut être associée à 0, 1 ou maximum 2 électrons.
On représente
souvent les cases quantiques par un carré, dans lesquels se positionnent les
électrons.
Un électron seul dans une case est un électron impair, ou célibataire,représenté par: 
Si deux électrons occupent une même case,ils sont appariés, ils constituent une paire, ou un doublet.
Il sera par représenté par deux fleches à orientation opposée : 
Puisque une case ne
peut comporter plus de 2 électrons, il existe un nombre maximal d'électrons pour chaque couche :
et un nombre
maximal d'électrons dans une sous-couche:
Le
nombre d'électrons maximum par couche Nmax(n) pour
les premiers quatre valeurs du nombre principal est le suivant : K (n=1) - 2 électrons, L (n=2) - 8 électrons, M (n=3) - 18 électrons, N (n=4) -32 électrons, e.t.c. Par voie de conséquence une sous-couche p (l=1) ne peut comporter plus de 6 électrons, une sous-couche d (l=2) - 10 électrons, une sous-couche f (l=3) - 14 électrons, e.t.c.
L'ensemble des
sous-couches qui constituent les couches K, L, M et N est repris dans le
tableau, qui indique également le nombre maximum d'électrons qui peuvent
occuper une sous-couche donnée.
Principe de l'énergie minimale
L'atome est formé d'un noyau chargé positivement
et d'un nuage d'électrons chargé négativement. Il y a interaction entre les
particules et le système possède une énergie. L'état de plus basse énergie est appelé état fondamental d'un
système.
A l'état fondamental d'un atome (l'état dans
lequel il se trouve habituellement), le remplissage
d'électrons se fait en complétant les niveaux d'énergie dans l'ordre d'énergie croissante
On appelle ce
principe également « principe d'Aufbau » (de construction). Pour obtenir l'état de plus basse
énergie de l'atome, on repartit les électrons dans les différentes sous-couches
de manière à remplir d'abord les sous-couches de plus basse énergie à
concurrence du nombre maximum d'électrons autorisé. Par exemple, le premier électron se place dans
l'état présentant le niveau d'énergie le plus bas, le second électron dans
l'état suivant de plus basse énergie, etc.
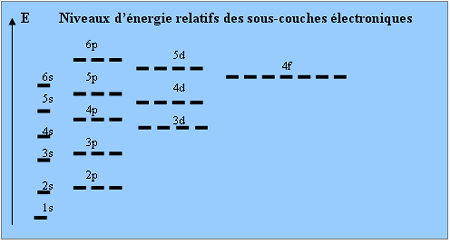
L'énergie de la sous-couche augmente lorsque n augmente, et pour
une valeur de n donnée, lorsque l augmente. Par contre, il n'y a
pas de différence d'énergie entre les cases quantiques d'une même sous-couche.
Cette figure est valable pour de nombreux atomes, mais il y a des exceptions
qui sont d'autant plus fréquentes que le nombre atomique Z augmente. On notera par exemple que l'orbitale 4s a une énergie
légèrement plus faible que celle des orbitales
3d pour les éléments
dont le numéro atomique est inférieur à 21.
Principe de Hund
Dans l'état
fondamental, lorsque plusieurs orbitales atomiques de même énergies sont
libres, les électrons se placent de façon à en occuper le plus grand nombre
possible (le plus d'espace possible).
Une paire d'électrons avec des spins identiques est légèrement plus énergétique qu'une paire d'électrons avec des spins opposés. Puisque deux électrons sur la même orbitale doivent avoir des spins opposés, cela fait que les électrons "préfèrent" occuper tout d'abord des orbitales différentes les uns des autres. Cette préférence se manifeste d'elle-même si une sous-couche avec l > 0 (une qui contient plus d'une orbitale) n'est pas complète. Par exemple, si une sous-couche p contient quatre électrons, deux électrons occuperont une orbitale, mais les deux autres occuperont chacun une des orbitales restantes, et leur spin sera le même.
|
||||||||||||||||