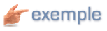|
Les constituants de l?atome
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
Le noyau
L'atome n'est la
particule ultime de la matière qu'en apparence. La structure réelle est
complexe. On y distingue essentiellement un noyau entouré d'un nuage
d'électrons.
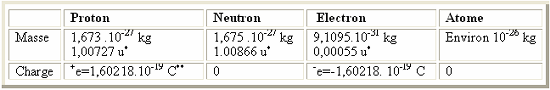
Le noyau est constitué d'un assemblage de particules appelées nucléons qui peuvent être soit des neutrons soit des protons. Les protons portent une charge
électrique positive +e, et de masse sensiblement égale à 1 dans l'échelle des
masses atomiques relatives.
Les neutrons sont
des particules fondamentatales non chargés électriquement et de masse très
voisine de celle des protons.
Le nuage électronique
Les électrons, des particules
fondamentatales de charge négative et très légères, gravitent autour du noyau
de l'atome. Ces électrons se placent à des distances differentes dans un espace
très grand par rapport au diamètre du noyau, formant ainsi le nuage
électronique.
Le nucléide
Un nucléide est
l'ensemble des atomes dont les noyaux contiennent le même nombre de protons et
de neutrons. Un nucléide
sera représenté par :
Chaque valeur du
numéro atomique Z qui est égal au nombre de protons définit un élément. Le
nombre de masses A (nombre de nucléons dans le noyau de l'atome) s'obtient en
faisant l'arrondi de la masse relative. Par conséquent, le nombre de neutrons N
s'obtient en faisant A - Z.
Les ions
Un atome, qui a perdu ou gagné un ou plusieurs électrons n'est plus électriquement neutre.C'est un ion.
Si un atome gagne un électron, c'est un ion chargé négativement, il est appelé anion.
Si un atome perd un électron, c'est un ion chargé positivement, il est appelé cation.
Les isotopes
Les isotopes sont
des atomes, dont les noyaux ont le même nombre de protons, mais des nombres de
neutrons différents. Deux isotopes ont donc le même numéro atomique Z, mais un
nombre de masse A différent.
Ce sont des
éléments chimiques qui se retrouvent dans la même case dans le tableau de
Mendeleïev, car ils possèdent les mêmes propriétés chimiques que l'élément qui
le représente. En effet les propriétés sont déterminées par le nombre d'électrons
et celui-ci reste identique.
Les éléments
naturels sont presque toujours des mélanges d'isotopes dans différentes
proportions.
On définit une masse nucléidique relative (Ar)
comme le rapport de la masse d'un atome du nucléide considéré au douzième de la
masse du nucléide 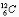 .Cette masse moyenne tient compte de la composition
isotopique naturelle. En pratique, on la calcule en faisant une moyenne des
masses atomiques relatives des isotopes constitutifs, pondérée par la
composition isotopique naturelle.
.Cette masse moyenne tient compte de la composition
isotopique naturelle. En pratique, on la calcule en faisant une moyenne des
masses atomiques relatives des isotopes constitutifs, pondérée par la
composition isotopique naturelle.
|
||||||||||||||||||||||||||||||||||||||||||||