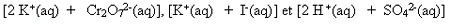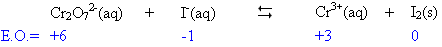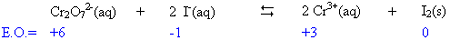|
Exemple de la seconde méthode
|
|
||||||||||||
|
SITUATION
Équilibrer une
réaction d'oxydo-réduction
Exemple de la seconde
méthode
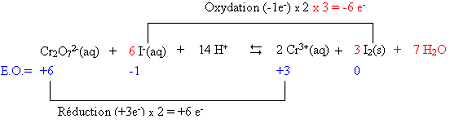
Équilibrer la réaction
entre des solutions aqueuses de dichromate de potassium et d'iodure de
potassium en présence de sulfate d'hydrogène; il se formera du diiode et des
ions Cr3+.
INTERPRETATION
1. Écrire les formules des
particules en présence
2. Repérer les systèmes
redox impliqués dans la réaction et écrire une équation faisant apparaître
uniquement les partenaires redox
3. Déterminer les états
d'oxydation des atomes intervenant dans
la reaction
puis équilibrer le nombre
d'atomes qui
changent d'E.O.
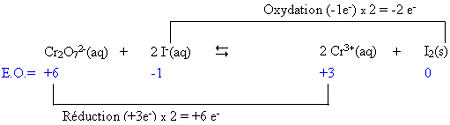
4. Indiquer le nombre
d'électrons échangés
dans chacun des deux systèmes en reliant les deux
partenaires de chacun des couples par une ligne
6. Équilibrer les charges
électriques en ajoutant dans l'un ou
l'autre membre soit des ions H+(aq)
si la réaction a lieu en milieu acide, soit des ions OH-(aq)
si elle a lieu en milieu basique, et ajouter dans l'autre membre des molécules
d'H2O pour équilibrer les atomes O et H.
Dans cet exemple, il y a 8 charges négatives à gauche et
6 charges positives à droite, il faut donc ajouter 14 ions H+(aq) à
gauche. À droite, on complète l'équation par l'addition de 7 molécules d'H2O.
|