|
Structure électronique des atomes
|
|
||||||||||||
|
Orbitale atomique
Les électrons d'un
atome n'ont pas tous la même énergie et ne se trouvent pas tous à la même
distance du noyau. Au début du siècle, la mécanique quantique a montré
que chaque électron est localisé dans un volume de l'espace que l'on appelle une
orbitale atomique. La probabilité d'y trouver
l'électron est 99%.
Une orbitale
atomique définit donc un état pour un électron (c'est-à-dire à la fois
l'énergie et la géométrie de la région de l'espace où il se trouve).
Les nombres quantiques
Les orbitalesatomiques sont caractérisées par les valeurs de quatre paramètres, qui sontles quatre nombre quantiques n, l, m, et s. Lesnombres n et s sont des variables indépendantes,mais l et m ne peuvent prendre que certaines valeurs, en fonctionde celle de n. Ainsi,pour un nombre quantique principal n donné, ilexiste n valeurs possibles de l: l=0,1, 2,.. n-1. Pour unnombre quantique secondaire l donné, il existe 2(l-1)+1 valeurs possibles de m. A l'exception du spin s, ils peuvent prendre que des valeursentières.
Organisation du
nuage électronique
A chacun des trois premiers nombres quantiques (n, l et m) correspond un niveaud'organisation du nuage électronique.
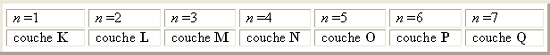
 L'ensemble d'électrons qui possèdent le
même nombre n constitue une couche électronique. Les couches sont désignées par unsymbole. Les couches définies par les premières sept valeurs de n sont: L'ensemble d'électrons qui possèdent le
même nombre n constitue une couche électronique. Les couches sont désignées par unsymbole. Les couches définies par les premières sept valeurs de n sont:

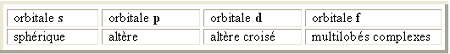
 Parmi les électrons d'une couche, ceux qui possèdent la même valeur de n et aussi de l constituent un sous-ensemble appelé sous-couche ou niveau d'énergie. Les premiers quatre valeurs de l (l *
(n-1)) definissent les sous-couches appelées s, p, d et f. Parmi les électrons d'une couche, ceux qui possèdent la même valeur de n et aussi de l constituent un sous-ensemble appelé sous-couche ou niveau d'énergie. Les premiers quatre valeurs de l (l *
(n-1)) definissent les sous-couches appelées s, p, d et f.


 Parmi les électrons
d'une sous-couche, ceux qui possèdent le même nombre m appartiennent à la même case
quantique (on dit aussi orbitale atomique, notée par OA). Parmi les électrons
d'une sous-couche, ceux qui possèdent le même nombre m appartiennent à la même case
quantique (on dit aussi orbitale atomique, notée par OA). Chaque valeur de m (-l *
m
*
l) définit 1 case quantique dans la sous-couche s, 3 cases quantiques dans la sous-couche
p, 5 - dans la
sous-couche d, 7 - dans la sous-couche f, etc.
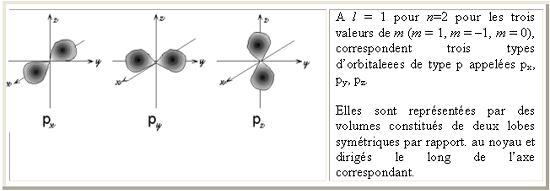
Les nombres quantiques l et m déterminent la géométrie de cette orbitale atomique : l caractérise la forme et m décrit son orientation spatiale.
Pour les premières quatre valeurs de l les formes caractéristiques sont:
A l=0 correspond une orbitale de type s dont la distribution électronique est sphérique autour du noyau. Il y a des orbitaleees 1s, 2s, 3s, etc correspondant à n = 1, 2, 3,etc.
On les représente
par des sphères centrées sur le noyau.
Le nombre quantique de spin (ms = ±1/2) est relié aux
champs magnétiques produits par la rotation de l'électron.
Il caractérise les 2 états
de rotation possibles de l'électron sur lui-même.
|