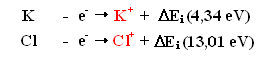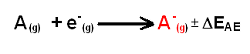|
Périodicité des propriétés des éléments
|
|
||||||||||||||||||||||||||||||||
|
Les propriétés
physiques et chimiques de la matière (état, dureté, conductivité, réactivité
chimique) dépendent des forces liant les atomes entre eux.
Ces forces
dépendent de la structure électronique des atomes en particulier des énergies
de liaison entre noyaux et électrons des couches externes. Il est donc logique
de trouver cette périodicité des éléments, entre autre pour des rayons
atomiques et ioniques, l'énergie ionisation, l'affinité électronique et l'électronégativité.
Propriétés électriques et structurales des éléments
En fonction de leur
conductivité les éléments peuvent être classifiés en métaux, non métaux
(métalloïdes) et semi-conducteurs (semi-métaux).
La conductivité des
métaux est grande et diminue avec la température. La conductivité des
non-métaux est très faible c.a.d. ils sont des isolants. Enfin la conductivité
des semi-conducteurs est intermédiaire entre celle des métaux et des isolants.
Certains éléments ont des
formes allotropiques
: dans l'une
l'élément est isolant, dans l'autre - semi-conducteur. Par exemple, tandis que l'étain blanc (Sn) est
conducteur, l'étain gris (Sn) est semi-conducteur.
En général le comportement
métallique se manifeste chez les éléments de transition, les groupes I, II et
les éléments plus lourds des groupes IIIA, IVA et VA. En ce qui s'agit de la
structure, les éléments métalliques possèdent des structures cristallines.
Les éléments
métalloïdes sont les membres les plus légers des groupes IVA, VA, VIA et VIIA.
Ils se présentent sous la forme de petites molécules covalentes comme N2,Cl2, S8.
Les
semi-conducteurs sont disposés sur une diagonale dans le tableau périodique:
B - Si - Ge - As -
Te. Les semi-conducteurs ont des structures cristallines qui peuvent être des
réseaux tridimensionnels ou des molécules à longue chaîne.
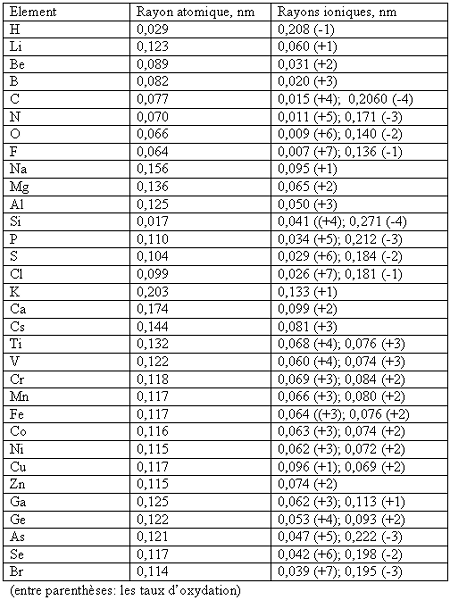
Les rayons atomiques et ioniques
Le rayon
atomique
Selon Lenard-Joues
le rayon atomique est la plus courte distance entre les noyaux de deux atomes
d'un gaz libre divisée par 2.
Le tableau
représente les variations du rayon en fonction du numéro atomique des éléments.
En comparant les
rayons en verticale c.a.d. en groupe on constate que le rayon atomique augmente
vers les éléments plus lourds. Donc le rayon des éléments d'une même colonne
augmente avec Z, par exemple - Li, Na, K, Rb, Cs (colonne IA) ou F, Cl, Be, I,
At (colonne VIIA).
L'interprétation de
ces variations périodiques met en jeu deux facteurs:
Rayons ioniques
Les ions obtenus
par cession ou capture d'électrons à partir d'atomes neutres présentent
nécessairement des dimensions différentes de celles de ces derniers, comme il
est facile de le constater en les comparant les rayons des cations et des
anions.
Le tableau comprend les valeurs exactes de quelques éléments et ions.
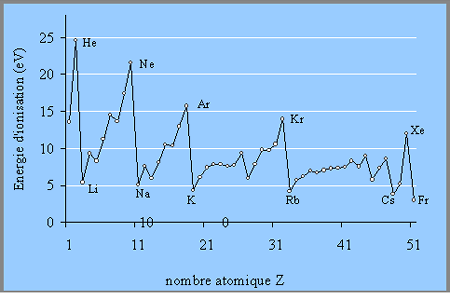
Energie
d'ionisation
L'énergie
d'ionisation est l'énergie minimale nécessaire pour l'extraction d'un électron
de l'enveloppe électronique d'un atome pour former ainsi un ion positif gazeux.
où Ei est égale à l'énergie avec laquelle l'atome retient son électron, enélectronVolt (eV) ou kJ/mol.
Par exemple, les énergies d'ionisation de l'atome de potassium K et de chlore
Cl sont comme suit:
Il est donc plus facile d'arracher l'électron 4s1 du potassium qu'un des électrons 3d du chlore.
L'énergie d'ionisation *Ei
est donc une valeur
quantitative de la stabilité de la structure électronique de l'atome isolé.
Elle est d'autant plus faible que l'électron est plus éloigné du noyau, La
dinunition de *Ei avec Z est due à
l'écranisation des électrons de valence par les électrons qui les séparent du
noyau et diminuent l'énergie d'attraction.
La figure compare les énergies d'ionisation des
éléments des cinq premières périodes.
Dans les valeurs de *Ei il y a une périodicité pareille à celle des propriétés
chimiques. L'énergie d'ionisation des métaux alcalins est plus faible en
comparaison des gaz rares. L'énergie d'ionisation des autres éléments a des
valeurs intermediaires.
Affinité
électronique
L'affinité
électronique c'est l'énergie qui se dégage (ou absorbe) à l'attraction d'un
électron sur un atome.
Une affinité électronique positive veut dire qu'il faut de
l'énergie pour enlever l'électron de l'ion, et une affinité électronique négative
signifie que l'ion
isolé est instable.
Pour la plus grande partie des atomes à l'attraction d'un électron se dégage (libère) de l'énergie - donc, une affinité électronique négative.
Si l'attraction de
l'électron nécessite un apport d'énergie d'extérieure ? l'affinité est
positive.
L'affinité
électronique dépend d'une façon périodique du nombre d'électrons de valence.
Pour l'hydrogène (H) et le sodium (Na) respectivement l'affinité électronique est négative, caril y a une tendance de formation de la structure stable s2.
Pour Be, Mg, métaux
alcalino-terreux, N, Mn et gaz nobles, l'affinité électronique est positive,
car leurs orbitales s, p et d sont soit complètes, soit mi-remplies.
Pour les halogènes
l'affinité
électronique est fortement négative, car il faut un seul électron pour la
formation de la configuration électronique d'un gaz noble.
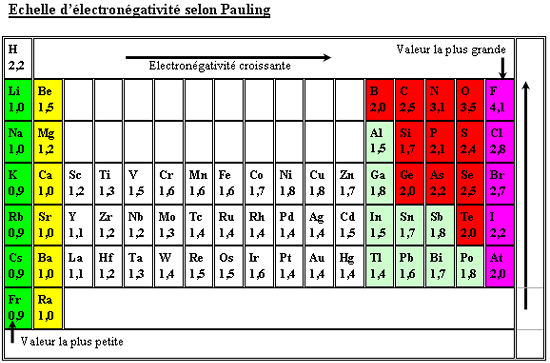
L'électronégativité
C'est le pouvoir d'un atome
d'attirer ? lui les électrons. Selon la
définition de Milliken l'électronégativité *
est égale à la
moyenne arithmétique de l'énergie d'ionisation *Ei et de l'affinité électronique *EiAE:
*=(*Ei +*EiAE)/2
Selon la définition
de Pauling
Pauling c'est le pouvoir
d'un atome d'attirer à lui les électrons
qui est basée sur la valeur expérimentale
des énergies de liaison. L'électronégativité relative des éléments se mesure sur une échelle
arbitraire allant de 0 à 4, proposée
par Pauling
Les valeurs numériques de
l'electronégativité augmentent avez le nombre
atomique Z dans chaque période
avec quelques
irrégularités, notamment pour les éléments de transition.
Dans un groupe donné ont constate une diminution l'électronégativités avec
Z.
Les éléments de
faible électronégativité (<2)
correspondent sensiblement à ce que l'on appelle métaux, les éléments de forte
électronégativité (>2) aux non-métaux .
Ces deux ensembles sont
séparés par des éléments appelés usuellement semi-métaux .
Les non-métaux sont
dans la partie droite et en haut du tableau périodique. Les métaux ? à gauche
et en bas. Les semi-métaux sont au voisinage d'une oblique séparant les
domaines des non-métaux et des métaux.
|
||||||||||||||||||||||||||||||||